
Enlaces de carbono
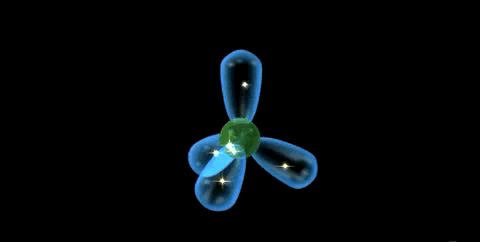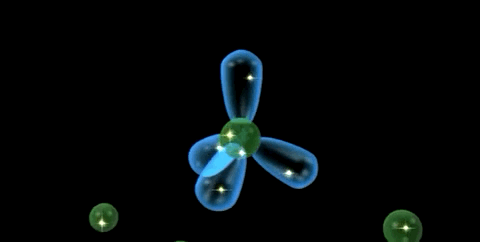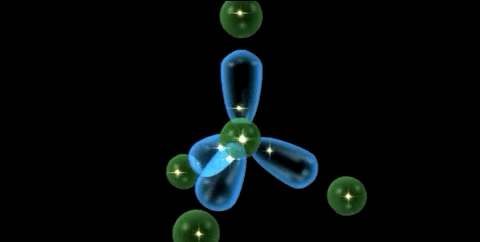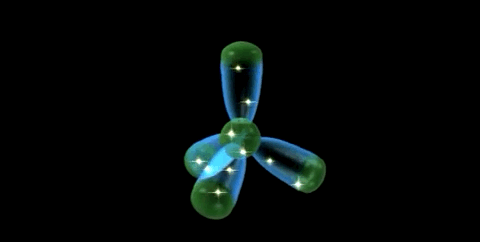
Las propiedades de un elemento están definidas por su configuración electrónica. La estructura fundamental del átomo de carbono (Z=6) es 1s2 2s2 2p1 x 2p1 y 2p0 , pero su valencia covalente es 4.
.png)
La tetravalencia del carbono se explica debido a que un electrón 2s se promueve a un orbital 2p, creando así 4 electrones no apareados. De esta manera, se forma los 4 enlaces covalentes y se crea un octeto estable energéticamente favorable.
Los compuestos del carbono
La estructura atómica del carbono le otorga gran capacidad para formar enlaces covalentes muy estables. Por esta razón, el carbono es el elemento que presenta mayor número de compuestos.
Aprende más jugando aquí
Representación de las moléculas orgánicas

Se utilizan 3 tipos de fórmulas:
• Fórmula empírica nos indica la relación sencilla entre los átomos de la molécula, o lo que es lo mismo la proporción en que se combinan átomos de elementos diferentes para formar la molécula. La Fórmula molecular es múltiplo de la fórmula empírica y nos informa de la composición real del compuesto.
• Fórmulas desarrolladas o semidesarrolladas, indican la distribución de los enlaces en la molécula, sean simples, dobles o triples, y la disposición de cada átomo en molécula.
• Fórmula espacial indica la distribución espacial de cada uno de los enlaces en la molécula, es decir representa en el plano la ordenación tridimensional de los enlaces.
