

Orbitales moleculares para el enlace covalente

Los orbitales moleculares son regiones del espacio que contienen la densidad electrónica definida por funciones matemáticas que describen el comportamiento ondulatorio que pueden tener los electrones en las moléculas. Estas funciones pueden usarse para calcular propiedades químicas y físicas tales como la probabilidad de encontrar un electrón en una región del espacio.
Aprende teoría aquí

Teoría de los orbitales moleculares
Consideraremos los orbitales moleculares en moléculas compuestas por dos átomos idénticos (H2 o Cl2, por ejemplo). Estas moléculas se denominan moléculas diatómicas homonucleares. En estas moléculas diatómicas se dan varios tipos de orbitales moleculares.
El proceso matemático de combinación de orbitales atómicos para generar orbitales moleculares se denomina combinación lineal de orbitales atómicos (CLOA).

Tipos de orbitales moleculares
Enlazantes: De menor energía que cualquiera de los orbitales atómicos a partir de los cuales se creó. Se encuentra en situación de atracción, es decir, en la región internuclear. Contribuyen al enlace de tal forma que los núcleos positivos vencen las fuerzas electrostáticas de repulsión gracias a la atracción que ejerce la nube electrónica de carga negativa que hay entre ellos hasta una distancia dada que se conoce como longitud de enlace.
Antienlazantes: De mayor energía, y en consecuencia, en estado de repulsión.
-
Orbitales σ enlazantes: combinación de orbitales atómicos s con p (s-s p-p s-p p-s). Enlaces "sencillos" con grado de deslocalización muy pequeño. Orbitales con geometría cilíndrica alrededor del eje de enlace.
-
Orbitales π enlazantes: combinación de orbitales atómicos p perpendicuales al eje de enlace. Electrones fuertemente deslocalizados que interaccionan fácilmente con el entorno. Se distribuyen como nubes electrónicas por encima y debajo del plano de enlace.
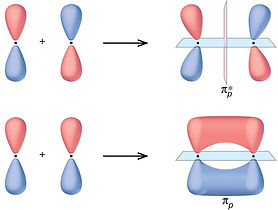

3. Orbitales σ* antienlazantes: versión excitada (de mayor energía) de los enlazantes.
4.Orbitales π* antienlazantes: orbitales π de alta energía.5.Orbitales n: para moléculas con heteroátomos (como el N o el O, por ejemplo). Los electrones desapareados no participan en el enlace y ocupan este orbital.
REFUERZA TU APRENSIZAJE CON ESTOS EJERCIOS DALE CLICK AQUÍ